
题目列表(包括答案和解析)
(12分)回答下列问题
(1)CH4、CO2、COCl2和 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成 键有_______mol和形成
键有_______mol和形成 键有_______mol。
键有_______mol。
(5)H2O熔沸点都比H2S高,其原因是___________________________________________。
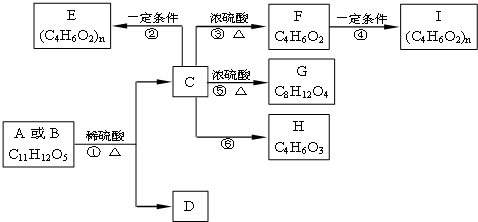
 )和某合成鞣剂(
)和某合成鞣剂(  )的原料之一.相关的合成路线如下图所示(某些生成物已略去):
)的原料之一.相关的合成路线如下图所示(某些生成物已略去):
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)





 ,X的结构简式为
,X的结构简式为



| 8.36(t2-t1) |
| c1 |
| 8.36(t2-t1) |
| c1 |

| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com