
题目列表(包括答案和解析)
| ||
| ||
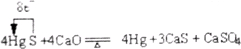
10分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
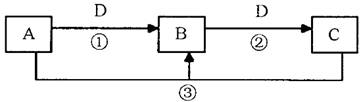
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ;工业上制取A的离子方程式为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若D空气质量预报必报的气体,A、B、C的的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是 (请写出试剂名称)。
(10分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法 该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色)+2H+Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法 该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(结合电极反应式解释) ;
溶液中同时生成的沉淀还有
(10分)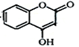 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: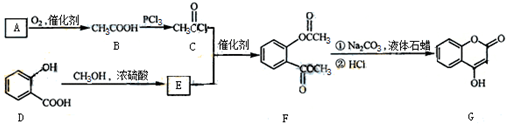
请回答下列问题:
【小题1】A与银氨溶液反应有银镜生成,写出A被新制氢氧化铜悬浊液氧化成B的化学方程式: 。
【小题2】B→C的反应类型是 。
【小题3】E的结构简式是 。
【小题4】F和氢氧化钠溶液共热的化学反应方程式:
【小题5】下列关于G的说法不正确的是( )
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
(10分)X、Y、Z、W是元素周期表前四周 期中的四种常见元素,其相关信息如下表:
期中的四种常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63, 中子数为 中子数为 34 34 |
 。反应过程中涉及的离子方程式为: 、
。反应过程中涉及的离子方程式为: 、湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com