
题目列表(包括答案和解析)
下图一是人类某一类型高胆固醇血症的分子基础示意图(控制该性状的基因位于常染色体上,以D和d表示)。根据有关知识回答下列问题:
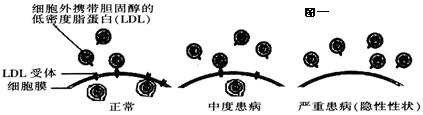
(1)控制LDL受体合成的是____性基因,基因型为________的人血液中胆固醇含量高于正常人。
(2)由图一可知携带胆固醇的低密度脂蛋白(LDL)进入细胞的方式是______,这体现了细胞膜具有____________的特点。
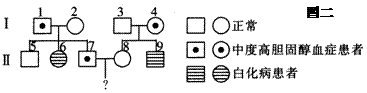
(3)下图二是对该高胆固醇血症和白化病患者家庭的调查情况,Ⅱ7与Ⅱ8生一个同时患这两种病的孩子的几率是____,为避免生下患这两种病的孩子,Ⅱ8必需进行的产前诊断方法是________。若Ⅱ7和Ⅱ8生了一个患严重高胆固醇血症的孩子,其最可能原因是发生了________。
假设某动物种群中,最初一对等位基因B、b的频率B=0.75,b=0.25,若环境的选择作用使B基因的频率不断降低,若干代后B、b的频率B=0.25,b=0.75,则在整个进化过程中,群体中基因型为Bb的频率变化规律是
A.不断增加 B.不断降低 C.先增加后降低 D.基本不变
在自然界中,生物变异处处发生;下面是几个变异的例子:①动物细胞在分裂过程中突破“死亡”的界限成为不死性的癌细胞;②杂合体(Rr)的红花豌豆植株,产生了基因型为rr的白花植株后代;③R型活细菌与S型细菌的DNA混合后转化为S型活细菌;④某同卵双胞胎兄弟,哥哥长期在野外工作,弟弟长期在室内工作,哥哥与弟弟相比脸色较黑。上述四种变异的来源依次是
A.基因突变、基因突变、基因重组、环境改变
B.基因重组、基因突变、基因重组、环境改变
C.基因突变、基因重组、染色体变异、基因突变
D.基因突变、基因重组、染色体变异、环境改变
据研究,某种植物的理想品种能合成两种对人类疾病有医疗价值的药物成分,其合成途径如下图所示。请回答有关问题:
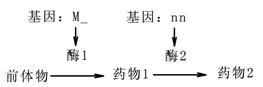
(1)酶Ⅰ的合成场所是 ,上述药物成分的合成途径可以体现基因与性状的关系是: 。
(2)现有两纯种植物,一种只能合成药物1,另一种两种药物都不能合成,这两种植物杂交,Fl都只能合成药物l,Fl自交产生的F2中的三种表现型:只能合成药物1:两种药物都能合成:两种药物都不能合成=9:3:4。F2的性状分离比说明基因M(m)与N(n)的遗传遵循 规律。两种亲本植物的基因型分别是 、 ,F2代两种药物都能合成的植物中能稳定遗传的个体所占的比例为 ,将F2中只能合成药物l的种子播种后进行自交,后代出现能合成两种药物的纯合子的比例是 。
(3) 用上述方法选育能合成两种药物的纯种植株,费时较长,欲尽快选育出理想植株,可以利用F1植物的花粉进行 ,再用秋水仙素或 使其染色体加倍,从中选育能合成两种药物的植株。
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com