
题目列表(包括答案和解析)

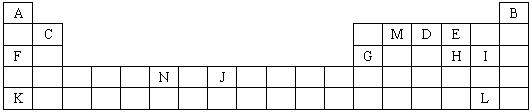

下图是元素周期表中的一部分。表中所列的字母分别代表某一化学元素。
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力 b.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(单位:![]() )
)
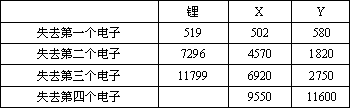
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需的能量。
________。
②表中X可能为以上13种元素中的________(填写字母)元素。用元素符号表示X和j形成化合物的化学式________。
③Y是周期表中________族元素。
④以上13种元素中________(填写字母)元素原子失去核外第一个电子需要的能量最多。
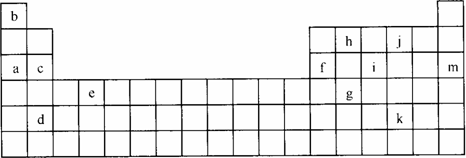
(14分)下图是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素:
(1)上述元素的单质中熔点最高的可能是________(填字母)。
(2)在一定条件下,a与e可形成一种简单化合物,其晶体类型为________,空间结构是________;a与d形成的简单化合物中含________键。(填“极性”或“非极性”)
(3)现有另一种元素X,其原子获得一个电子时所释放出的能量比表中所列元素中都要大,则X是________元素,属于周期表中________族元素。
(4)NH3·H2O的电离方程式为试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com