
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||
为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施 ;
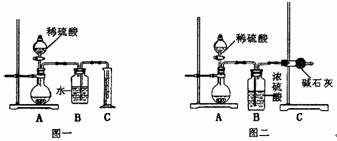
(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①
②
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品m g,放入锥形瓶中加蒸馏水溶解,加1―2滴酚酞指示剂,用物质的量浓度为c mol?L―1的HCl溶液滴定至溶液由红色至无色(指示CO32―+H+=HCO3―反应的终点),消耗HCl溶液体积为V1mL,再加入1―2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++HCO3―=CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2ml。则烧碱样品中Na2CO3的质量分数为 ;
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤
②用测得的数据(用字母表示)写出质量分数的表达式 。

请回答下列问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性:____________________________________________________________________;
(2)C装置中氢氧化钠溶液的作用是______________________________________________;
(3)D装置中反应的化学方程式为________________________________________________;
(4)利用上述实验方案测原样品中亚硫酸钠的质量分数,除了已知亚硫酸钠样品的质量外,根据实验的可行性还需测定的数据是___________;
(5)现有以下试剂:蒸馏水、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液,请从中选择合适的试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度,写出你设计的实验方法中所用到的试剂_______________。
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施_______________________。

(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①__________________________________________________________________,
②__________________________________________________________________。
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品mg,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色至无色(指示![]() +H+
+H+![]()
![]() 反应的终点),消耗HCl溶液体积为V1mL,再加入1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++
反应的终点),消耗HCl溶液体积为V1mL,再加入1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++![]()
![]() CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2mL。则烧碱样品中Na2CO3的质量分数为_____________________。
CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2mL。则烧碱样品中Na2CO3的质量分数为_____________________。
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤。
②用测得的数据(用字母表示)写出质量分数的表达式_______________。
 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:| 53(W3-W1) |
| 22W2 |
| 53(W3-W1) |
| 22W2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com