
题目列表(包括答案和解析)
(12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)= mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中离子浓度由大到小的顺序是: 。
③混合溶液中由水电离出的c(H+) 同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)= mol/L。
(12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)= mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中离子浓度由大到小的顺序是: 。
③混合溶液中由水电离出的c(H+) 同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)= mol/L。
(12 分 )某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n (Na2O)] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100 mol•L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
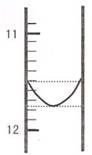 (1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
(2)该混合碱样品的组成为 ,理
由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
(12 分 )某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100 mol•L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
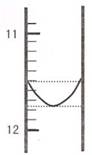 (1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
|
序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
|
I |
? |
26.85 |
|
II |
10.02 |
25.02 |
|
III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 ,理
由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
(12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:
属于酸性氧化物的有_____________,属于碱性氧化物的有_____________,
属于盐的有__________________________________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________,
④ 不属于四种基本反应类型的氧化还原反应_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com