
题目列表(包括答案和解析)
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||

(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液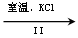 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。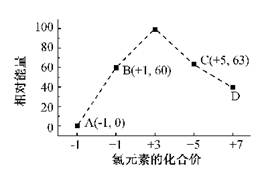
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
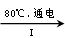 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体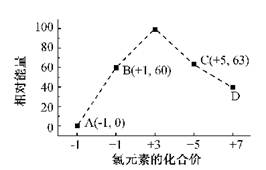
〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com