
题目列表(包括答案和解析)
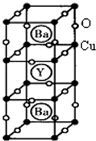
(12分) (物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品——紫色的硅酸铜钡。凑巧的是,后者正是发现于中汉代器物上的被称为“汉紫”的颜料,还发现于秦俑彩绘。 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
(1)给出铜在周期表中的位置(周期和族)
(2)写出基态Cu原子的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
(4)①某+1价铜的配离子为[Cu(CN)4]3-,与其配体互为等电子体的一种微粒是
(写化学式)。
②许多+1价铜的化合物的溶液能吸收CO和烯烃(如C2H4、CH3-CH=CH2……),CH3-CH=CH2分子中C原子的杂化方式是 、 。
(5)在硫酸铜溶液中逐滴加入氨水至过量,观察到先出现蓝色沉淀,最终沉淀溶解得到深蓝色的溶液。写出蓝色沉淀溶解的离子方程式 。
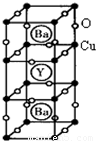
 (物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘.
(物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘.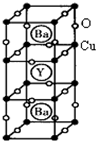
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com