
题目列表(包括答案和解析)

(NH4)2SO4+FeSO4+6H2O![]() (NH4)2Fe(SO4)2·6H2O。
(NH4)2Fe(SO4)2·6H2O。
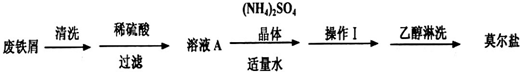
某研究性学习小组设计的在实验室用废铁屑制备莫尔盐的步骤如下:
①将废铁屑放入10%的Na2CO3溶液中煮沸除油污,冷却,洗涤,倾析得铁屑;
②将处理过的铁屑放入过量的3 mol·L-1 H2SO4溶液中,控温在50 —
③将一定量硫酸铵加入到硫酸亚铁溶液中,使其完全溶解;
④从溶液中分离出莫尔盐晶体。
试回答:
(1)步骤②中存在设计缺陷,应改进为_________________,改进的目的是(用离子方程式表示)_________________。
(2)步骤④从溶液中分离出莫尔盐晶体的实验操作包括________________________。
(3)请设计实验,检验莫尔盐晶体中是否含有Fe3+。__________________________。
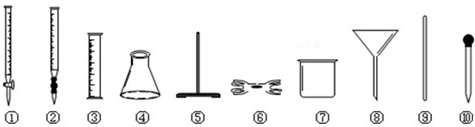
硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH4)2SO4·FeSO4·6H2O],相对分子质量为392,是常用的分析试剂.在实验室,将FeSO4和(NH4)2SO4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体.某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品.请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
________.
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+.离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O.滴定时必须选用的仪器有________(从下图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂?________.若需要,请指出加什么指示剂;若不需要,请说明理由.________.

(3)取莫尔盐产品23.520 g,配成250 mL溶液,取出25.00 mL用0.0500 mol/L KMnO4溶液滴定,消耗KMnO4溶液19.50 mL,则产品中莫尔盐的质量分数________.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com