
题目列表(包括答案和解析)
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。

(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液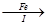 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
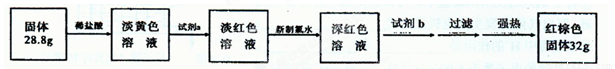
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液![]() FeSO4溶液
FeSO4溶液![]() FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。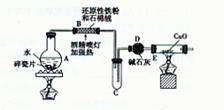
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液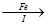 FeSO4溶液
FeSO4溶液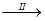 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。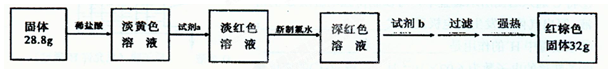
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com