
题目列表(包括答案和解析)
已知A、B、C、D均为化合物,B、C常温常压下为气体,C气体可使湿润的红色石蕊试纸变蓝色;又知1 mol A在200℃时分解仅得1 mol B 和一定量的水两种产物,A中含有NO3-。A、B、C、D间有如下关系:
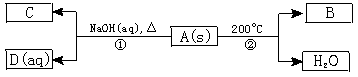
试回答下列问题:
(1)写出A、C的化学式:A 、C 。
(2)写出反应①的离子方程式:___________________。
(3)写出反应②的化学方程式,并标出电子的转移方向和数目:____________________。

| |||||||||||||||||||||||


 ,你认为
,你认为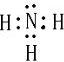
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com