
题目列表(包括答案和解析)
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ、查阅资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.
Ⅱ、牙膏样品中碳酸钙的定量测定:
利用下图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.
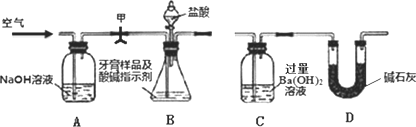
实验步骤:
①如上图所示连接好装置,先检查装置的气密性;
②准确称取牙膏样品的质量4.00 g,并在各仪器中加入相应试剂;
③打开弹簧夹甲,缓缓通入空气,然后接上C;
④打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
⑤待B中不再产生气体后停止滴加盐酸;
⑥将C中沉淀过滤、洗涤、干燥,得BaCO3;
⑦称量BaCO3的质量为1.97 g.
依据实验过程回答下列问题:
(1)步骤④通过空气的作用有:________、________.
(2)步骤⑥中检验沉淀洗干净的方法是________.
(3)本实验测定得到的样品中碳酸钙的质量分数为________.若采取下列措施,对测定结果的准确度没有影响的是________(填标号).
a.省略步骤③
b.滴加盐酸快一些
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.多次实验,取平均值计算
(4)有同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数.请你说明是否可以并简要说明理由________.
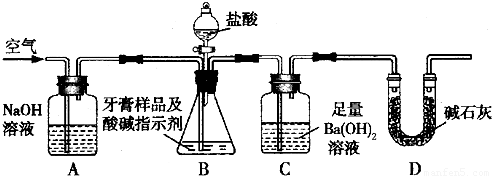
14 分苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为: 
已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com