
题目列表(包括答案和解析)
已知反应:mX(g) + nY(g) 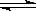 qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )
| A.通入稀有气体,压强增大,平衡正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.增加X的物质的量,Y的转化率降低 |
已知反应:mX(g)+ nY(g) qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
已知反应:mX(g)
+ nY(g)  qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
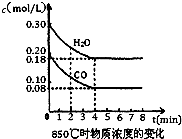 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.| 1 | 2 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com