A、B、C、D、E五种主族元素分属于三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB
2、DB,两种分子.请回答下列问题:
(1)E在元素周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
,其核外电子排布式为
1s22s22p63s23p5
1s22s22p63s23p5
,五种元素的原子半径由小到大的顺序为
H<O<Cl<S<Na
H<O<Cl<S<Na
(用元素符号回答).
(2)A、B两种元素能形成两种常温下均呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为
;化合物N具有较高的沸点,原因是
水分子间存在氢键
水分子间存在氢键
.
(3)在上述元素最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(写化学式,下同),非金属气态氢化物还原性最强的是
H2S
H2S
.
(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有
NaOH、Na2SO3
NaOH、Na2SO3
(任写两种化合物,用化学式表示,下同).
(5)B、E的单质或由两元素形成的化合物牛可作消毒剂的有
O3、Cl2、ClO2
O3、Cl2、ClO2
.


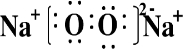
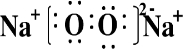




 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
