
题目列表(包括答案和解析)

| ||
| ||

化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.
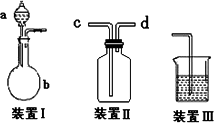
(1)甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入________或________,b仪器中加入________或________(与a中分别对应).装置Ⅱ从________管口进气即可作为O2的收集装置.
(2)丙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:________
(3)戊同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入________试剂,b仪器中加入_________试剂,装置Ⅲ中应加入适量的________试剂,根据装置Ⅲ中观察到的________实验现象即可得出Cl2的氧化性比Br2强的结论.


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com