维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C
6H
8O
6.维生素C易被空气中的氧气氧化.在新鲜的水果,蔬菜,乳制品中都富含有维生素C,如新鲜橙汁中维生素C的含量为500mg?L
-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量,下面是测定分析的实验报告:
(1)测定目的:测定XX牌软包装橙汁中维生素C的含量.
(2)测定原理:C
6H
8O
6+I
2→C
6H
6O
6+2H
++2I
-.
(3)实验用品:
①实验仪器:酸式滴定管,铁架台,锥形瓶,滴管等.
②试剂:指示剂
淀粉
淀粉
(填名称),7.5×10
-3mol?L
-1标准碘液,蒸馏水.
(4)实验步骤:
①洗涤仪器:检查滴定管是否漏水,润洗好后装好标准碘液.
②打开软包装橙汁,目测颜色(橙黄色,澄清度好),用酸式滴定管向锥形瓶中移入20.00ml待测橙汁,滴入2滴指示剂.
用左手控制滴定管的
活塞
活塞
(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点,判断滴定终点的现象是
最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色
最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色
.
③记下读数,再重复操作两次.
(5)数据记录处理,若经数据处理,滴定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量为
990
990
mg?L
-1.
(6)误差分析:若在实验中存在下列操作,其中会使维生素C的含量偏低的是
AD
AD
A.量取待测橙汁的仪器水洗后未润洗
B.锥形瓶水洗后未用待测液润洗
C.滴定前尖嘴部分有一气泡,滴定终点时消失
D.滴定前仰视读数,滴定后俯视读数.

 如图为细菌冶铜和火法冶铜的主要流程.
如图为细菌冶铜和火法冶铜的主要流程.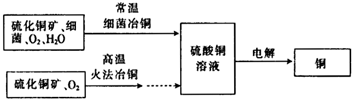

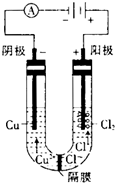
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.