
题目列表(包括答案和解析)
 卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题 (1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.图示法和图像法都是常用的科学研究方法。
(1)科学家通过X射线推测胆矾中既含有配位键又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

①写出基态Cu原子的核外电子排布式________________________________。
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)________。
(2)下图是研究部分元素氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________(填“a”或“b”),理由是______________________________________________________________。

(3)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E)。如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是________;
②根据图中提供的信息,试推断E氧________E氟(填“>”、“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,试推断E镁________E钙。
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为________,NF3分子的空间构型为________。
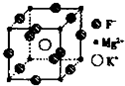
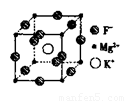
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A 、B 、C 、D 。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式 。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
【解析】考查元素周期表的结构和核外电子的排布规律。1S轨道为半充满的是氢元素,即A是H。电负性最大的就是非金属性最强的,所以B是F。C2+的电子排布式和Ar相同,Ar的原子序数是18,所以C是Ca。原子序数为24的是Cr,则D是Cr。由于Cr最后填入的单质在d轨道上,所以Cr属于d区;CaF2是由离子键形成的离子化合物,其电子式为 ;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com