
题目列表(包括答案和解析)

(10分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2 → HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为 ,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为 。
⑵ 联氨的电子式为 。

⑶ 上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
①D点时溶液中各离子的浓度由大到小的顺序为
② B点时溶液中c (HN3) =
(10分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2 → HN3(叠氮酸) + H2O (未配平);
+ HNO2 → HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为 ,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为 。
⑵联氨的电子式为 。
⑶上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
① D点时溶液中各离子的浓度由大到小的顺序为
D点时溶液中各离子的浓度由大到小的顺序为
② B点时溶液中c  (HN3
(HN3 ) =
) =
A.NaN3可用于汽车防撞保护气囊 B.NaN3的水溶液呈碱性
C.NaN3的固体属于离子晶体 D.HN3分子中各原子都满足8电子稳定结构
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
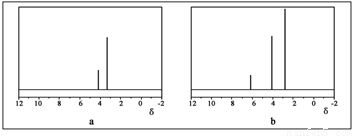
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 。该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
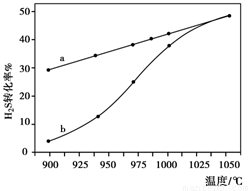
(4)已知H2S高温热分解制H2的反应为:H2S(g) H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(5)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l)=CO2(g)+2H2(g)现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于右图所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com