
题目列表(包括答案和解析)
 某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
| ||
| ||
| 你的判断 | NH2 | HCl |  |
| 能够制的 | a中药品: 浓氨水 浓氨水 b中药品: 氢氧化钠固体或氧化钙 氢氧化钠固体或氧化钙 |
a中药品: 浓盐酸 浓盐酸 b中药品: 浓硫酸 浓硫酸 | |
| 不能制的 | 原因: 无 无 |
原因: 无 无 |
| 1 |
| 22.4 |
| 1 |
| 22.4 |
(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)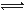 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。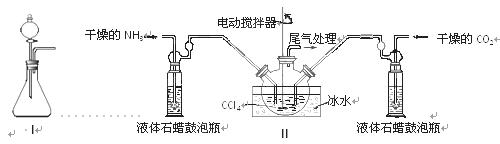
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程如下:
NH3+CO2+H2O === NH4HCO3;NH4HCO3+NaCl === NaHCO3↓+NH4Cl;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。

第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
②装置c中的试剂为 (选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述): 。
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
I.工业上有多种方法来制备氮氦化硅,常见的方法有:
方法一 直接氦化法:在1300~1400℃时,高纯粉状硅与纯氦气化合,其反应方程式为
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氦气、氢气反应生成氦化硅和HCl,与方法一相比,用此法制得的氦化硅纯度较高,其原因是 。
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体
(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
II.(1)氨化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氨化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有 。
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)==Si3N4(s) △H=—750.2kJ/mol
Si(s)+2Cl2(g)==SiCl4(g) △H=—609.6kJ/mol
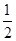 H2(g)+
H2(g)+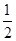 Cl2(g)==HCl(g) △H=—92.3kJ/mol
Cl2(g)==HCl(g) △H=—92.3kJ/mol
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:
。
III.工业上制取高纯硅和四氯化硅的生产流程如下:
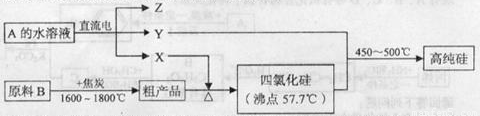
已知:X,高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)原料B的主要成分是 。
(2)写出焦炭与原料B中的主要成分反应的化学方程式: 。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu? (填“能”或“不能”)。
写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极: ;阴极: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com