
题目列表(包括答案和解析)
(7分)从某物质A的水溶液出发有下图所示的一系列变化:
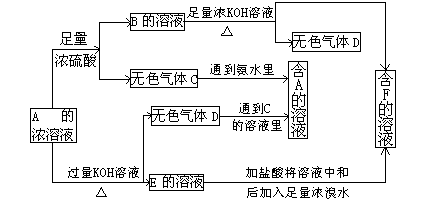
(1)写出下列物质的化学式:www.7caiedu.cn
A 、C 、F 。
(2)写出下列反应的离子方程式
A→E________________________;
E→F________________________。
![]() 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
![]()

![]() (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
![]() ①电源的N端为______极;
①电源的N端为______极;
![]() ②电极b上发生的电极反应为_________________________;
②电极b上发生的电极反应为_________________________;
![]() ③列式计算电极b上生成的气体在标准状况下的体积:
③列式计算电极b上生成的气体在标准状况下的体积:
![]() _________________________________
_________________________________
![]() ④电极c的质量变化是_________g;
④电极c的质量变化是_________g;
![]() ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
![]() 甲溶液______________________________;
甲溶液______________________________;
![]() 乙溶液______________________________;
乙溶液______________________________;
![]() 丙溶液______________________________;
丙溶液______________________________;
![]() (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
![]() _____________________________________。
_____________________________________。
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4制备KMnO4的离子方程式是 。
(3)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(4)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16.00 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为_____。
已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
(7分)从某物质A的水溶液出发有下图所示的一系列变化: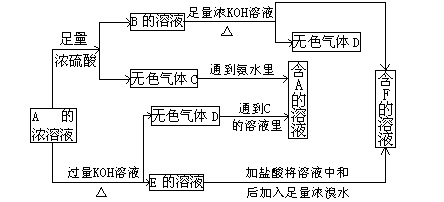
(1)写出下列物质的化学式:w.w.w.k.s.5.u.c.o.m
A 、C 、F 。
(2)写出下列反应的离子方程式
A→E________________________;
E→F________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com