(2011?如皋市模拟)氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu
2+、Fe
3+的电镀废液中制备氯化亚铜的工艺流程图.
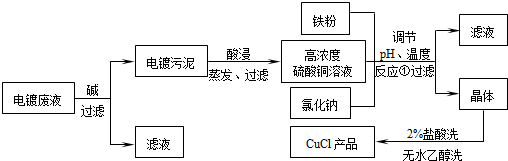
如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.

试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:
Fe3++3OH-=Fe(OH)3↓;Cu2++2OH-=Cu(OH)2↓
Fe3++3OH-=Fe(OH)3↓;Cu2++2OH-=Cu(OH)2↓
.
(2)由反应①制备CuCl时的最佳pH在
3.5
3.5
左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有
能被空气中的氧气氧化
能被空气中的氧气氧化
的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:
2Cu2++2Cl-+Fe=2CuCl↓+Fe2+
2Cu2++2Cl-+Fe=2CuCl↓+Fe2+
.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:
2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4
2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4
.

 2Cu+CO2;②2Mg+CO2
2Cu+CO2;②2Mg+CO2 2MgO+C,由此得出的下列结论正确的是( )。
2MgO+C,由此得出的下列结论正确的是( )。 2H2(g)+O2(g)△H=+484kJ?mol-1;测得20min时O2的物质的量为0.0016mol,则前20min的反应速率v(H2O)=
2H2(g)+O2(g)△H=+484kJ?mol-1;测得20min时O2的物质的量为0.0016mol,则前20min的反应速率v(H2O)=