已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:
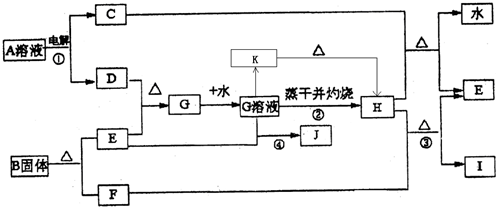
(1)反应①阳极的电极反应式
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.
(2)反应③的化学方程式
.
(3)反应④的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.
(4)K是一种难溶于水的固体,K受热分解可生成H.实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
ABCD
ABCD
A.NaOH溶液 B.氨水 C.Na
2CO
3溶液 D.NaHCO
3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl
FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl
,该液体接通直流电后
阴
阴
极附近颜色加深,这种过程叫做
电泳
电泳
.
(6)若E中含有合金元素,会导致G不纯.测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移
到
100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol?L
-1Na
2S
2O
3溶液滴定(I
2+2S
2O
32-=2I
-+S
4O
62-),共用去VmL.(杂质不参与反应)则样品中G的质量分数为:
.
(7)B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子.则B的化学式为
Fe(CO)5或者FeC5O5
Fe(CO)5或者FeC5O5
.














 到
到