
题目列表(包括答案和解析)
为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
实验一:制备并收集一试管二氧化氮
(1)实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式是________
(2)可用下图装置制备并收集一试管二氧化氮,
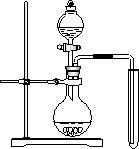
①在加入药品前,必须进行的操作是________.
②该装置的缺点是(只填一个缺点既可)________.
实验二:尽可能多地使试管中的二氧化氮被水吸收
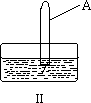
(3)将装有二氧化氮的试管A倒插入水中(图Ⅱ),并轻轻晃
动试管,观察到的现象是:________.
(4)从下图中挑选所需的仪器,完成制取O2,并将O2通入到上述实验后的试管A中.
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管.固定装置不用画),并标明所用试剂.
②某同学在试管A内通入O2的过程中没有观察到液面上升,而是试管内充满了无色气体,可能原因是________.
(8分)为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
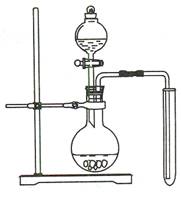 实验I:制备并收集一试管二氧化氮
实验I:制备并收集一试管二氧化氮
(1)某同学用右图装置制备并收集一试管二氧化氮该装置的缺点是(只填一个缺点即可)
。
实验II:尽可能多地使试管中的二氧化氮被水吸收
(2)将一支充满二氧化氮的试管A倒放在盛有水的水槽中(如图),并轻轻晃动试管,观察到的现象是: ,
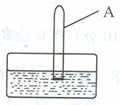
反应的化学方程式是 。
(3)在该装置的基础上,请你设计实验,要求尽可能多地使试管中的二氧化氮被水吸收,实验步骤是 。
A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答
26.(A)实验室模拟合成氨和氨催化氧化的流程如下:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从下图中选择制取气体的合适装置:

氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次
(6)若测定结果x值偏高,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 胆矾晶体部分风化
(14分)夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
⑵下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,是二元弱酸,其主要的电离方程式可表示为__________
D的化学式是_____ ____。②A、B、E中均含有的一种元素为____________ (填元素名称) 。
③E电子式为____________________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式
。
⑶在实验室我国科研人员应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N。
(14分)夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
⑵下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:

①B的水溶液呈弱酸性,是二元弱酸,其主要的电离方程式可表示为__________
D的化学式是_____ ____。②A、B、E中均含有的一种元素为____________ (填元素名称) 。
③E电子式为____________________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式
。
⑶在实验室我国科研人员应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com