
题目列表(包括答案和解析)
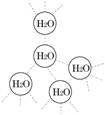 (5分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体――冰。
(5分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体――冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 KJ/mol,而冰的熔化热为5.0KJ/mol,说明
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com