
题目列表(包括答案和解析)



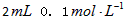 H2C2O4溶液,另取两支试管各加入
H2C2O4溶液,另取两支试管各加入 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。 已知KMnO4和H2C2O4在酸性溶液中发生反应:
KMnO4+ H2C2O4+ H2SO4 — K2SO4+ MnSO4+ CO2↑+ H2O(请配平)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
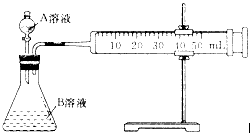
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
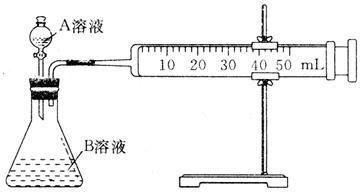
实验时A溶液一次性放下,A,B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1L H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2![]() 0.1
0.1![]() H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4![]() 0.1
0.1![]() KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
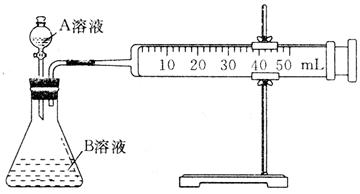
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1L H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
 率的大小。取两支试管各加入2
率的大小。取两支试管各加入2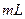 0.1
0.1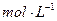 H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4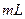 0.1
0.1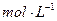 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com