
题目列表(包括答案和解析)
| ||

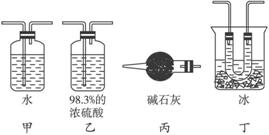
图5-6
(1)请你从图5-6所示的装置中选择能使SO2与SO3分离的装置,将其编号及其作用原理填入表中。
选用装置(标号) | 简答实验原理 |
|
|
|
|
(2)试评价你所选择的每一件装置的不足之处,择其一条予以说明,并提出简单可行的改进措施。
(Fe2O3),反应原理是:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)
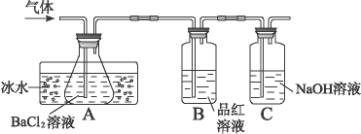
请回答相关问题:
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是_______________,发生反应的离子方程式为_________________________________________________________。
(2)B瓶所盛试剂的作用是______________________________________;C瓶所盛试剂的作用是___________________________________________________________。
(3)A瓶要用冷水冷却的原因是______________________________________________。
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理______(填“合理”“不合理”),理由是______________________________________。
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:_______________________________________________________________。
2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)
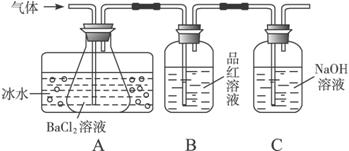
请完成相关问题:
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是____________,发生反应的离子方程式为__________________。
(2)B瓶所盛的试剂的作用是__________________________________;C瓶所盛试剂的作用是____________________________________________。
(3)A瓶要用冷水冷却的原因是______________________________________。
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理________(填“合理”“不合理”),理由是________________________________。
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:________
________________________________。
![]()
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)?

请回答相关问题:?
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是________,发生反应的离子方程式为________________________。
(2)B瓶所盛的试剂的作用是________________;C瓶?所盛试剂的作用是________________。
(3)A瓶要用冷水冷却的原因是________________________。?
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理________(填“合理”“不合理”),理由是________________________。?
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com