
题目列表(包括答案和解析)
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: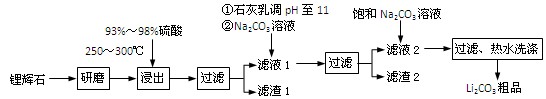
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
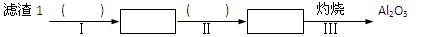
(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g) 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。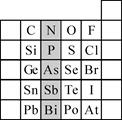
①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g)![]() 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
( 12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g)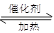 2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A (g)  B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,C2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
 (3) 如果2A
(g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
(3) 如果2A
(g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com