
题目列表(包括答案和解析)
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| 复方氢氧化铝 | 盐酸雷尼替丁 | |||
| 滴定前 | 滴定后 | 滴定前 | 滴定后 | |
| 1 | 0.01 | 79.8 | 0.02 | 18.6 |
| 2 | 0.00 | 79.5 | 0.03 | 19.0 |
| 3 | 0.03 | 80.5 | 0.00 | 18.7 |
| 时间(min) | 0 | 0.5 | 1 | 1.5 | 2 | 2.5 | 3 | 3.5 | 4 | 5 |
| 复方氢氧化铝 | 3.53 | 3.62 | 3.70 | 3.75 | 3.79 | 3.84 | 3.88 | 3.89 | 3.90 | 3.92 |
| 盐酸雷尼替丁 | 1.72 | 1.65 | 1.60 | 1.55 | 1.74 | 1.80 | 1.84 | 1.87 | 1.87 | 1.88 |
| 时间(min) | 10 | 15 | 20 | 25 | 30 | 35 | 40 | |||
| 复方氢氧化铝 | 3.97 | 4.01 | 4.12 | 4.13 | 4.14 | 4.15 | 4.15 | |||
| 盐酸雷尼替丁 | 1.88 | 1.87 | 1.88 |
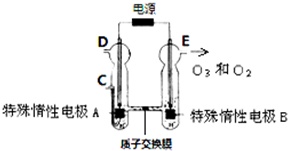 (2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
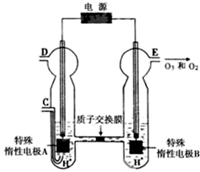 (2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| x-2y |
| y |
| x-2y |
| y |
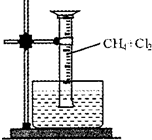 (2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:
(2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:| 光照 |
| 光照 |
| 编号 | 1 | 2 | 3 | 4 | 5 |
| 光照时间 | 2min | 4min | 6min | 8min | 10min |
| 反应后pH | 1.86 | 1.62 | 1.00 | 1.00 | 1.00 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com