
题目列表(包括答案和解析)
 (12分)某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金。
(12分)某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金。
(1)写出铝和氧化铁在高温下反应的化学方程式: ▲ 。
(2)设计一个最简单的实验方案,证明上述所得的块状熔融物中含有金属铝。写出表示该实验原理的离子方程式: ▲ 。
(3)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充 www..com
分反应,发现反应过程中无气体放出。在反应结束后的溶
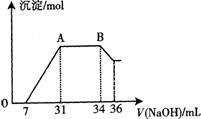
液中,逐滴加入4mo1·L—1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。试回答下列问题:
①熔融物与稀硝酸充分反应后,还原产物NH4NO3的物质的量为 ▲ mol。
②熔融物中金属铝和金属铁的物质的量的之比为 ▲ 。

(8分)某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金。
(1)设计一个最简单的实验方案,证明上述所得的块状熔融物中含有金属铝。写出表示该实验原理的离子方程式: 。
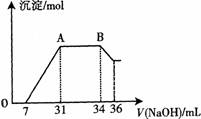 (2)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mo1?L―1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。
(2)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mo1?L―1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。
试回答下列问题:
①熔融物与稀硝酸充分反应后,还原产物NH4NO3的物质的量为 。
②熔融物中金属铝的物质的量为 ;金属铁的物质的量为 。
(8分)某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金。
(1)设计一个最简单的实验方案,证明上述所得的块状熔融物中含有金属铝。写出表示该实验原理的离子方程式: 。
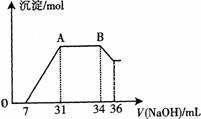 (2)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mo1·L—1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。
(2)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mo1·L—1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。
试回答下列问题:
①熔融物与稀硝酸充分反应后,还原产物NH4NO3的物质的量为 。
②熔融物中金属铝的物质的量为 ;金属铁的物质的量为 。
| ||
| a |
| b |
| 1 |
| 4 |
| a |
| b |
| 3 |
| 8 |
| 1 |
| 4 |
| a |
| b |
| 3 |
| 8 |
| a |
| b |
| 9 |
| 32 |
| 9 |
| 32 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com