
题目列表(包括答案和解析)
实验室需要0.2mol/L CuSO4溶液250ml,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4·5H2O) ②4mol/L CuSO4溶液
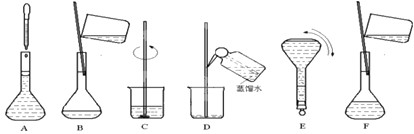
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是________,在使用该仪器前必须进行的操作是 。
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO4· 5H2O的质量为________g;如果用4mol/L的CuSO4溶液稀释配制,需用量筒量取___________ml4mol/L CuSO4溶液。
(3)实验室用4mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
其中正确的操作顺序为
①往烧杯中加入约100ml水进行初步稀释,冷却至室温
②用量筒量取一定体积4mol/L 的硫酸铜溶液于一烧杯中
③计算所需4mol/L 硫酸铜溶液的体积
④将溶液颠倒摇匀后转存于试剂瓶
⑤加水至液面离容量瓶1-2cm处改用胶头滴管进行定容
⑥洗涤烧杯和玻璃棒2-3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
⑦将溶液转移入容量瓶
(4)配制溶液过程中,如果出现以下情况,对结果有何影响(填“偏高”、“偏低”或“无影响”)
A.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
B.定容时俯视刻度线
C.容量瓶未干燥即用来配制溶液
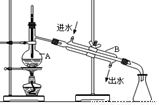
(5)实验过程中用到蒸馏水。如图为实验室制取蒸馏水的装置示意图。图中的两处明显的错误是 ______________________________;_______________________________。实验时A中除加入少量自来水外,还需加入少量___ ____,其作用是防止暴沸。
| ||
| ||
| ||
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
下列有关叙述正确的是
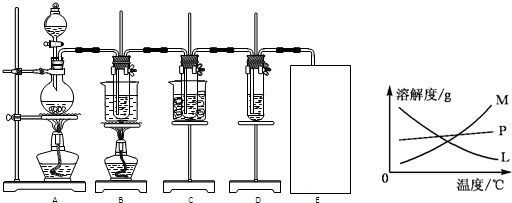
| A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com