
题目列表(包括答案和解析)
 N2O4(g)达到平衡.
N2O4(g)达到平衡. N2O4(g)的平衡常数K.
N2O4(g)的平衡常数K.(10分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO): 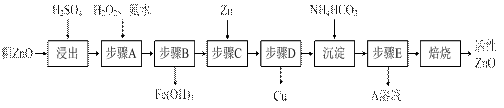
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
 度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):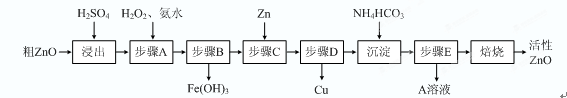
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(09江苏高考化学)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H= kJ·mol-1
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu 与足量的浓HNO3 反应,制得1.00L已达平衡的N2O4和NO2 混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu 多少克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com