
题目列表(包括答案和解析)
过二硫酸钾(K2S2O8)在高于100℃的条件下能发生分解反应,其化学方程式为
2![]()
![]()
![]() ↑
↑
现称取一定量的K2S2O8(固体)(含有不分解的杂质),进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和实验(SO3熔点为16.8℃)。
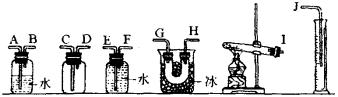
(1)试从下图中选用几种必要的装置,连接成一套实验装置,这些选用装置的接口编号连接顺序是________。
(2)将三氧化硫与水反应,鉴定反应产物中阴离子的方法是________。
(3)若实验时称取过二硫酸钾的质量为Wg,测得氧气的体积(折算成标准状况,标准状况下氧气的密度为1.429g·L-1)为a mL,则此过二硫酸钾的纯度为________。

过二硫酸钾(K2S2O8)在高于100℃的条件下能发生分解反应,其化学方程式为
2K2S2O8![]() 2K2SO4+2SO3↑+O2↑
2K2SO4+2SO3↑+O2↑
现称取一定量的K2S2O8(固体)(含有不分解的杂质),进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和实验(SO3熔点为16.8℃)。
(1)试从下图中选用几种必要的装置,连接成一套实验装置,这些选用装置的接口编号连接顺序是________。
(2)将三氧化硫与水反应,鉴定反应产物中阴离子的方法是________。
(3)若实验时称取过二硫酸钾的质量为Wg,测得氧气的体积(折算成标准状况,标准状况下氧气的密度为1.429g·L-1)为a mL,则此过二硫酸钾的纯度为________。

2![]()
![]()
![]() ↑
↑
现称取一定量的K2S2O8(固体)(含有不分解的杂质),进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和实验(SO3熔点为16.8℃)。
(1)试从下图中选用几种必要的装置,连接成一套实验装置,这些选用装置的接口编号连接顺序是________。
(2)将三氧化硫与水反应,鉴定反应产物中阴离子的方法是________。
(3)若实验时称取过二硫酸钾的质量为Wg,测得氧气的体积(折算成标准状况,标准状况下氧气的密度为1.429g·L-1)为a mL,则此过二硫酸钾的纯度为________。
2K2S2O8![]() 2K2SO4+2SO3↑+O2↑
2K2SO4+2SO3↑+O2↑
现称取一定量的K2S2O8(固体)(含有不分解的杂质),进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和实验(SO3熔点为16.8℃)。
(1)试从下图中选用几种必要的装置,连接成一套实验装置,这些选用装置的接口编号连接顺序是________。
(2)将三氧化硫与水反应,鉴定反应产物中阴离子的方法是________。
(3)若实验时称取过二硫酸钾的质量为Wg,测得氧气的体积(折算成标准状况,标准状况下氧气的密度为1.429g·L-1)为a mL,则此过二硫酸钾的纯度为________。

工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1mol O2发生反应,则下列说法正确的是??????????????????? 。
A.若反应速率v (SO2) ﹦v (SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.平衡后升高温度,平衡常数K增大
F.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为??????? ,? 表中y? ﹦?????? 。
②T1????????????????? T2 ,(选填“>”、“<”或“=”), 实验2中达平衡时 O2的转化率为???????????????? 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1 mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
① 该溶液中c(Na+)与 c(OH-) 之比为???????????????????????????????????????? 。
② 该溶液中c(OH-) = c(H+)+ ???????????? + ????????????? (用溶液中所含微粒的浓度表示)。
③ 当向该溶液中加入少量NaOH固体时,c(SO32-)???????????????? , 水的离子积Kw? ??? ??????????????? 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 ????????????????????????????????????????????? 。
A. Na2CO3???????? ?? B. Ba(NO3)2 ??????????? C.Na2S???????? D.酸性KMnO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com