
题目列表(包括答案和解析)
化工生产中涉及较多的化学原理、生产方法和工艺流程,请回答下列问题:
(1)工业上用硫铁矿生产硫酸的主要设备有__________、__________、__________。
(2)工业上制备硫酸,常采用__________(填编号)为吸收剂,以高效吸收三氧化硫。
a.自来水 b.蒸馏水 c.稀硫酸 d.98.3%硫酸
(3)侯氏制碱法中,用二氧化碳和氨气与饱和食盐水反应制碳酸氢钠,应先向饱和食盐水中通入_____。
(4)石油裂化分为热裂化、催化裂化和_______,其目的为__________________。
(5)为降低电解液熔点,工业上生产铝时需要加入的熔剂为____________________。
化工生产中涉及较多的化学原理、生产方法和工艺流程,请回答下列问题:
(1)工业上用硫铁矿生产硫酸的主要设备有__________、__________、__________。
(2)工业上制备硫酸,常采用__________(填编号)为吸收剂,以高效吸收三氧化硫。
a.自来水 b.蒸馏水 c.稀硫酸 d.98.3%硫酸
(3)侯氏制碱法中,用二氧化碳和氨气与饱和食盐水反应制碳酸氢钠,应先向饱和食盐水中通入_____。
(4)石油裂化分为热裂化、催化裂化和_______,其目的为__________________。
(5)为降低电解液熔点,工业上生产铝时需要加入的熔剂为____________________。
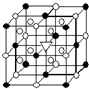 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
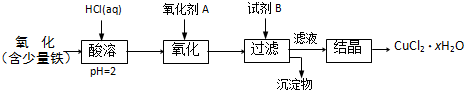
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com