
题目列表(包括答案和解析)
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示
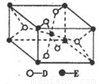
①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:__________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g)=2CA3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。

①试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。

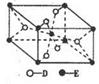

已知A、B、C、D、E为原子序数递增的五种短周期元素,A与C、B与D同主族。请回答:
(1)C2B2的电子式 ,A2B2属于 晶体(“分子”、“原子”或“离子”)。
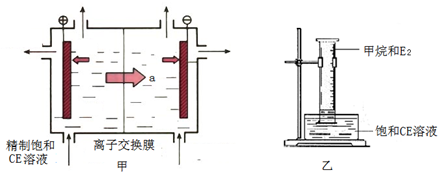
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图。透过交换膜的离子a是___,电解的离子方程式 。
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象 ,你认为Fe丝在E2也可点燃的理由是 。
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等。生成的物质有 种,水槽中的液体用饱和CE溶液而不用水的原因是 。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性写出该氧化还原反应的离子方程式![]() 。
。
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com