
题目列表(包括答案和解析)
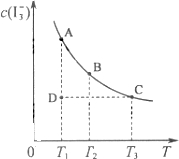
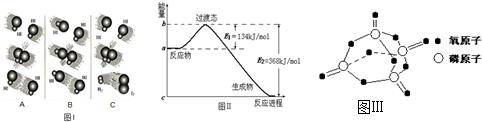

| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |
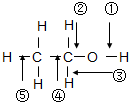 乙醇分子中各化学键如图所示,工业上可用乙烯水化法制得乙醇,下列对乙烯和乙醇的有关说法中不正确的是( )
乙醇分子中各化学键如图所示,工业上可用乙烯水化法制得乙醇,下列对乙烯和乙醇的有关说法中不正确的是( )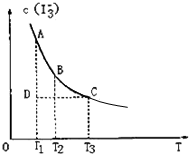 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?| I | - 3 |
| I | - 3 |
| I | - 3 |
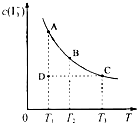 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com