(2013?朝阳区一模)工业上常以赤铁矿石(主要成分为Fe
2O
3)和焦炭为主要原料,在高温下炼铁.焦炭产生CO的反应是:
C+O
2CO
2; C+CO
2 2CO
(1)CO还原赤铁矿的化学方程式是
(2)下列说法正确的是
ab
ab
a.为使赤铁矿石充分燃烧,需将其粉碎
b.足量的空气能提高炼铁反应速率
c.与生铁相比较,纯铁转化为“铁水”的温度低
(3)生铁的用途很多,某电镀厂用生铁将废水中的Cr
2O
72-转化为Cr
3+,流程图1:
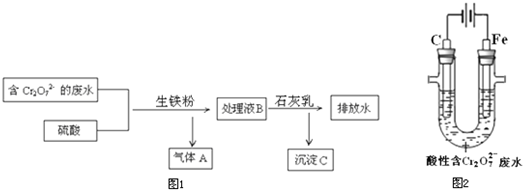
①气体A是
H2
H2
②在上述酸性溶液中,生铁比纯铁产生Fe
2+的速率快,原因是
生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率
生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率
③将Cr
3+转化为Cr(OH)
3的离子方程式是
2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+
2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+
(4)电解法将一定浓度的酸性废水中的Cr
2O
72-转化为Cr
3+,其原理示意图2:
①阳极附近溶液中Cr
2O
72-转化为Cr
3+的离子方程式是
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
②一段时间后,试管底部出现沉淀.解释生成沉淀的原因:
随着电解进行,溶液中c(H+)逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀
随着电解进行,溶液中c(H+)逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀
.