
题目列表(包括答案和解析)
| 3bmM |
| 1000a |
| 3bmM |
| 1000a |
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组
设计SnSO4制备路线如下:
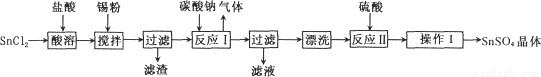
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2) SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m ml。则锡粉中锡的质量分数是________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
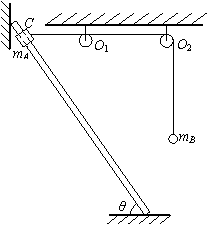 16.
16.
(如东启东期中联考13分)如图所示,一轻绳绕过无摩擦的两个轻质小定滑轮O1、O2和质量mB=m的小球连接,另一端与套在光滑直杆上质量mA=m的小物块连接,已知直杆两端固定,与两定滑轮在同一竖直平面内,与水平面的夹角θ=60°,直杆上C点与两定滑轮均在同一高度,C点到定滑轮O1的距离为L,重力加速度为g,设直杆足够长,小球运动过程中不会与其他物体相碰.现将小物块从C点由静止释放,试求:
(1)小球下降到最低点时,小物块的机械能(取C点所在的水平面为参考平面);
(2)小物块能下滑的最大距离;
(3)小物块在下滑距离为L时的速度大小.
| 100w |
| w+V |
| 100w |
| w+V |
| 1000ρw |
| M(w+V) |
| 1000ρw |
| M(w+V) |
| 100w |
| V |
| 100w |
| V |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com