
题目列表(包括答案和解析)
(07年江苏卷) (8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol?L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
(本题共8分)在玻璃生产中,熔炉里原料发生的主要反应为:
2Na2CO3+CaCO3+3SiO2 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑
(1).某反应物在熔融状态下不导电,它属于_____晶体。
(2).上述反应里,在周期表中相邻两元素的原子半径______>______(填元素符号) ,处于同一周期元素的名称是__________________。
(3).上述反应里金属性最强的短周期元素,其原子核外有______种不同能级的电子,其单质在O2中充分燃烧, 产物的电子式为_____________。
(4).H2与O2发生反应的过程用模型图示如下(“—”表示化学键):

其中过程Ⅰ是______过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的__________分子(填“极性”或“非极性”)。
(8分).处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g)。发生反应为:
(1)已知:CO(g)+ O2(g)=CO2(g) △H=-283.0kJ·mol—1
O2(g)=CO2(g) △H=-283.0kJ·mol—1
S(g)+O2(g)=SO2(g) △H= - 296.0 kJ·mol—1
试写出利用上述方法处理烟道气的热化学方程式
(2)在容积为2L的密闭容器中,充入4molCO和2molSO2,在一定条件下发生反应2CO(g)+SO2(g) S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
①0-2min内的平均反应速率v(CO)= 。
②该温度下,上述反应的平衡常数K= (填数值)。
③2min后改变下列条件能使上述反应的反应速率增大,且平衡向正 向移动的是
a. 选用更高效的催化剂 b.升高温度 c.及时分离出二氧化碳 d.增加SO2的浓度
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O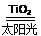 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O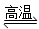 CO+3H2
CO+3H2
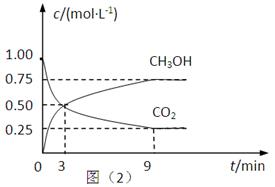
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
|
温度/℃ |
0 |
100 |
200 |
300 |
400 |
|
平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列说法正确的是_____。
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
.(8分)某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com