
题目列表(包括答案和解析)
H |
|
|
|
|
|
| He |
1.312 0 |
|
|
|
|
|
| 0.372 3 |
Li | Be | B | C | N | O | F | Ne |
0.520 3 | 0.899 5 | 0.800 1 | 1.086 4 | 1.402 3 | 1.314 0 | 1.681 0 | 2.080 7 |
Na | Mg | Al | Si | P | S | Cl | Ar |
0.495 8 | 0.737 7 | 0.577 6 | 0.786 5 | 1.011 8 | 0.999 6 | 1.251 1 | 1.520 5 |
K | Ca | Ga | Ge | As | Se | Br | Kr |
0.418 9 | 0.589 8 | 0.578 8 | x | 0.944 0 | 0.940 9 | 1.139 9 | 1.350 7 |
Rb | Sr | In | Sn | Sb | Te | I | Xe |
0.403 0 | 0.549 5 | 0.558 3 | 0.708 6 | 0.831 6 | 0.869 3 | 1.008 4 | 1.170 4 |
Cs | Ba | Tl | Pb | Bi | Po | At | Rn |
0.376 | 0.503 | 0.589 | 0.716 | 0.703 | 0.812 | 0.912 | 1.037 |
回答下列问题:
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是__________。说明同一主族元素从上到下__________能力逐渐增强。
(2)从表中数据预测Ge元素第一电离能x的取值范围_______________。
(3)观察第2、3周期中各元素的第一电离能,找出同一周期中元素第一电离能的变化规律。(说出一点即可)_______________。
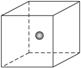
(4)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为一个正方体,其中心为Si原子,试在正方体的顶点画出与Si(用![]() 表示)最近的C(用
表示)最近的C(用![]() 表示)的位置。
表示)的位置。
H |
|
|
|
|
|
| He |
1.3120 |
|
|
|
|
|
| 0.3723 |
Li | Be | B | C | N | O | F | Ne |
0.5203 | 0.8995 | 0.8001 | 1.0864 | 1.4023 | 1.3140 | 1.6810 | 2.0807 |
Na | Mg | Al | Si | P | S | Cl | Ar |
0.4958 | 0.7377 | 0.5776 | 0.7865 | 1.0118 | 0.9996 | 1.2511 | 1.5205 |
K | Ca | Ga | Ge | As | Se | Br | Kr |
0.4189 | 0.5898 | 0.5788 | x | 0.9440 | 0.9409 | 1.1399 | 1.3507 |
Rb | Sr | In | Sn | Sb | Te | I | Xe |
0.4030 | 0.5495 | 0.5583 | 0.7086 | 0.8316 | 0.8693 | 1.0084 | 1.1704 |
Cs | Ba | Tl | Pb | Bi | Po | At | Rn |
0.376 | 0.503 | 0.589 | 0.716 | 0.703 | 0.812 | 0.912 | 1.037 |
回答下列问题。
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是________。说明同一主族元素从上到下________能力逐渐增强。
(2)从表中数据预测Ge元素第一电离能x的取值范围________。
(3)观察第2、3周期中各元素的第一电离能,找出同一周期中元素第一电离能的变化规律。
(说出一点即可) ________。
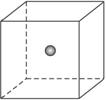
(4)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为一个正方体,其中心为Si原子,试在正方体的顶点画出与Si(用![]() 表示)最近的C(用○表示)的位置。
表示)最近的C(用○表示)的位置。

|
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).
下列说法错误的是: | |
A. |
Al的第一电离能的大小范围为Na<Al<Mg |
B. |
从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次增大 |
C. |
上图中第一电离能最小的元素在周期表中的位置是第五周期,IA族 |
D. |
根据对角线规则,Be、Al元素最高氧化物水化物的性质相似,它们都具有两性. |
| |||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com