
题目列表(包括答案和解析)
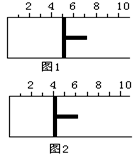
![]() 如右图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是
如右图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是
A.20% B.40% C.60% D.无法确定
如右图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B22AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是 ( )
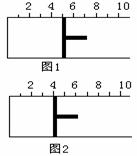
A. 20% B.40% C.60% D.无法确定
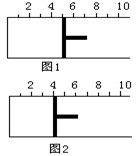

| A.20% | B.40% | C.60% | D.无法确定 |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:| nA |
| tA |
| 2-a |
| 2 |
| 2-a |
| 2 |
(14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)2NH3(g) △H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
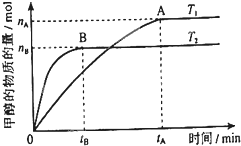
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的理是原来的,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2FCO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com