
题目列表(包括答案和解析)
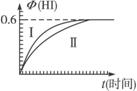
(1)达平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(Ⅰ)所示,则该条件可能是_________________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为______________(用一个含a、b、c的代数式表示)。
(4)室温时将0.01 mol HI气体溶于水配成100 ml 溶液,则该溶液中由水电离产生的氢离子的物质的量浓度为____________mol·L-1;若降低温度该溶液的pH将____________(填增大、减小或不变)。
常温下有浓度均为0.1mol·L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水。请根据题目要求回答下列问题。
(1) 上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是__________。
(2) 取适量溶液④,加入少量氯化铵固体,此时溶液中 ![]() 的值_____(填“增大” 或“减小”或“不变”)。
的值_____(填“增大” 或“减小”或“不变”)。
(3) 将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是:__________。 所得溶液的pH<7,用离子方程式表示其原因________________;混合后的溶液中由水电 离
出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(4) 取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=________________。
(5) 若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是__________。
(6) 有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.CH3COONH4;C.(NH4)2SO4; D.NH4Cl, 按pH由大到小的顺序排列_______ _(填序号)
将1 mol I2(g)和2 mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g);ΔH<0,并达到平衡.HI的体积分数Φ(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);ΔH<0,并达到平衡.HI的体积分数Φ(HI)随时间变化如图曲线(Ⅱ)所示:
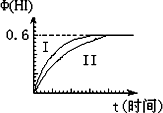
(1)达平衡时,I2(g)的物质的量浓度为________mol·L-1.
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线
(Ⅰ)所示,则该条件可能是________(填入下列条件的序号).
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为________(用一个含a、b、c的代数式表示).
(4)室温时将0.01 mol HI气体溶于水配成100 ml溶液,则该溶液中由水电离产生的氢离子的物质的量浓度为________mol·L-1;若降低温度该溶液的pH值将________(填增大、减小或不变)
已知25℃时几种物质的电离度(溶液浓度均为0.1 mol/L)如下表(已知硫酸的第一步电离是完全的):
(1)根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式________.
(2)25℃时,0.1 mol/L上述几种溶液中C(H+)由大到小的顺序是________(填序号,下同);
(3)25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是________;
(4)25℃时,0.1 mol/L H2SO4中的HSO4-的电离度小于0.1 mol/L NaHSO4中HSO4-的电离度的原因是:________.
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5Na |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 物质 | CH3OH | CHO3CH3 | H2O |
| 浓度/mol/L | 0.8 | 1.24 | 1.24 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com