
题目列表(包括答案和解析)
分子(或离子)的空间构型有直线形、角形、平面形、四面体形、三角锥形等。为了解释和预测分子的空间构型,科学家在归纳了已知分子的空间构型的基础上,提出一种简单的理论模型,其理论依据是:分子中的价电子对(包括成键电子对和孤对电子)由于相互排斥作用,而取向彼此远离以减小斥力,分子尽可能采取对称的空间构型。对于ABm形分子(A为中心原子,B为配位原子),分子中的价电子对数(n)可以通过下式确定:
![]()
| 分子构型 | AB2 | AB3 | AB2 | AB3 | AB4 |
| 价电子对数 | 2 | 3 | 4 | 4 | 4 |
| 几何构型 | 直线形 | 平面形 | 角形 | 三角锥形 | 四面体形 |
说明:①作为配位原子,氧原子、硫原子按不提供价电子计算;
②直线形分子中最少有3个原子,平面形分子中最少有4个原子。
(1)指出下面物质分子或离子的空间构型:PO43- ;CS2 ;AlBr3(共价分子) 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子 ,三角锥形分子 ,四面体形分子 。
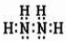
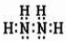
| ||
| ||


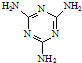 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 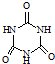 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com