
题目列表(包括答案和解析)
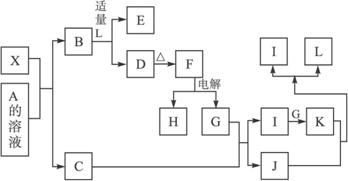
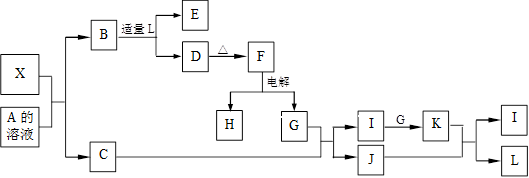
其中,C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。完成以下问题:
(1)写出X的化学式:_____________,X属于_____________晶体(填“原子”“分子”或 “离子”)。
(2)写出K与J反应的化学反应方程式________________________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
![]()
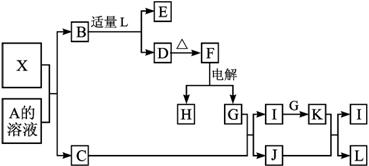
图1-3-21
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。完成以下各题:
(1)写出X的化学式:__________,X属于__________晶体(填“原子”“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:______________________________。写出K与J反应的化学方程式:____________________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料,是最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式):![]() +2N2
+2N2![]() 4X+SiC+3C。
4X+SiC+3C。
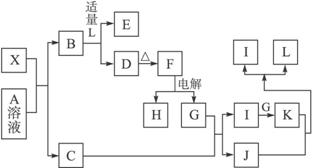
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液焰色反应火焰呈黄色。回答以下问题:
(1)写出X的化学式___________,X属于___________晶体(选填“原子”或“分子”或“离子”)。
(2)写出B与L溶液反应生成D的离子方程式:______________________,写出K与J反应的化学方程式:_____________________________.
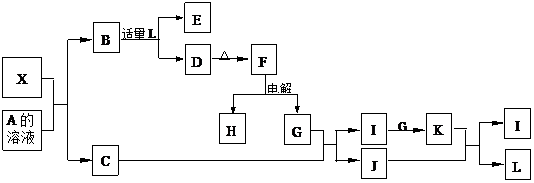 1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________ __________;
写出K与J反应的化学方程式:____________________________ _____。
| |
 (12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
(12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________ __________;
写出K与J反应的化学方程式:____________________________ _____。
![]() (3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。 +2N2
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。 +2N2![]() 4X+SiC+3C。
4X+SiC+3C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com