
题目列表(包括答案和解析)
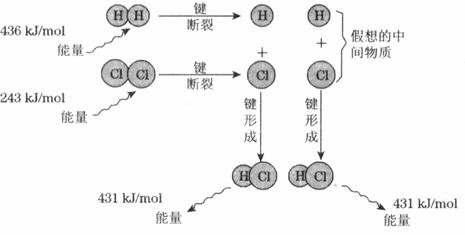
①化学键断裂需要____________(填“释放”或“吸收”)能量;
②图中共释放的能量____________kJ/tool;
③该反应的反应物的总能量___________(填“大于”“等于”或“小于”)反应产物的能量,所以该反应是__________反应;
④用图示数据计算其反应热,写出该反应的热化学方程式
___________________________________________________________________。
(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时
C(s,石墨)+O2(g)====CO2(g);△H1=-393.5 kJ/mol
CO(g)+寺O2(g)====CO2(g);△H3=-283.0 kJ/mol
写出石墨在氧气中反应生成一氧化碳的热化学方程式
_________________________________________________________________。
(1)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,下图表示上述反应能量变化的理论分析示意图:
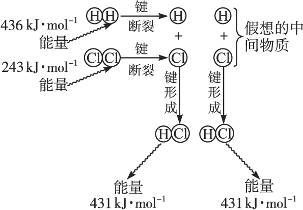
①化学键断裂需要________(填“释放”或“吸收”)能量;
②图中共释放能量________kJ·mol-1;
③该反应的反应物的总能量________(填“大于”“等于”或“小于”)反应产物的能量,所以该反应是________________反应;
④用图示数据计算其反应热,写出该反应的热化学方程式:____________________________。
(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时
C(s,石墨)+O2(g)====CO2(g);ΔH1=-393.5 kJ·mol-1 ①
CO(g)+![]() O2(g)====CO2(g);ΔH2= -283.0 kJ·mol-1 ②
O2(g)====CO2(g);ΔH2= -283.0 kJ·mol-1 ②
写出石墨在氧气中反应生成一氧化碳的热化学方程式___________________。
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如右图所示)。
 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是 。
②进行乙方案实验:准确量取残余清液稀释一定的倍数后作为试样。
a.量取试样20.00mL,用0.1000 mol·L—1NaOH标准溶液滴定,消耗22.00mL,该次滴定测的试样中盐酸浓度为 mol·L—1;
b.平行滴定后获得实验结果。
 ③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×![]() 、Ksp(MnCO3)=2.3×
、Ksp(MnCO3)=2.3×![]() ]
]
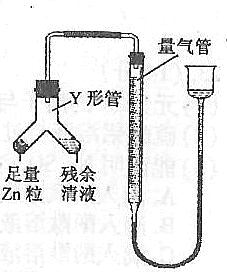
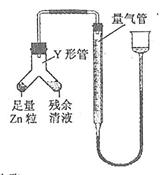
④进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因
是 (排除仪器和实验操作的影响因素)。
(1)工业上制取纯硅涉及以下三个反应:
①SiO2+2C![]() Si(粗)+2CO↑ ②Si(粗)+2Cl2
Si(粗)+2CO↑ ②Si(粗)+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
其中属于置换反应的有___ _;反应①、②、③的反应物中有C、H2、Cl2、SiO2,按照某种物质分类标准,它们中有一种物质与其他三种物质明显不同,该物质为 ,写出分类的依据 (只需写出一种分类方法)。
(2)碳、铝均能还原铁的氧化物。为确定混合物(含FeO、Fe2O3)的组成,现进行如下实验:
①取一定质量混合物与足量炭粉共热,只收集到CO气体m mol;
②取与①相同质量的混合物与足量铝进行铝热法炼铁,得到单质铁n mol则混合物中FeO的物质的量分数是 (用m、n表示)。
③经测定,消耗1mol碳粉还原固体Fe2O3生成固体铁和CO气体,放出akJ热量,请写出该反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com