
题目列表(包括答案和解析)
(每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L平底烧瓶 C、0.5L容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温 度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题: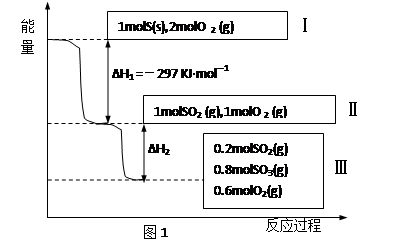
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)  2SO3(g) △H = -196.6 KJ·mol-1,
2SO3(g) △H = -196.6 KJ·mol-1,
①该热化学反应方程式的意义是 。
②图1中的ΔH2 = KJ·mol-1
③恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
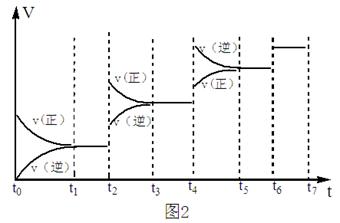
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率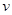 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
| A.t1~t2 | B.t3~t4 | C.t5~t6 | D.t7~t8 |
(每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L 平底烧瓶 C、0.5L 容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
(每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L 平底烧瓶 C、0.5L 容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题:


(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)
 2SO3(g)
△H = -196.6 KJ·mol- 1,
2SO3(g)
△H = -196.6 KJ·mol- 1,
①该热化学反应方程式的意义是 。
②图1中的ΔH2 = KJ·mol-1
③恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
A、t1~t2 B、t3~t4 C、t5~t6 D、t7~t8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com