
题目列表(包括答案和解析)
请回答(1)和(2)两小题:
(1)下列说法正确的是________(选填序号)
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先要检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol/L到0.008 mol/L等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液
②样品处理:

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL.
④比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度.
试回答下列问题:
①配制100 mL 0.01 mol/L标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:________、________.
②步骤②脱色过程包括加入:________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→________(填操作).
③步骤②样品处理中,氧化的目的是________.
(1)下列说法正确的是____________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol·L-1到0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
②样品处理:

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
④比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01 mol·L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:_______________、_______________。
②步骤②脱色过程包括加入____________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→____________(填操作)。
③步骤②样品处理中,氧化的目的是______________________________________________。
(1)下列说法正确的是__________。(选填序号)
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.一般在实验室点燃可燃性气体时,必须先要检验纯度
C.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
D.测定中和热时,环形玻璃搅拌棒要用力搅拌,使测得的温度更准确
E.测定硫酸铜晶体结晶水质量分数时,若用潮湿的坩埚会使测定结果偏大
F.石油蒸馏实验中,温度计必须插入液体中部。
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制 0.01 mol·L-1、0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
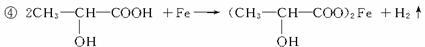
③准确量取一定体积的待测液于试管中(比色管),加入稍过量的KSCN溶液,并稀释至10 mL
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100 mL 0.01 mol·L-1 [Fe(SCN)6]3-溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要___________、___________。
②步骤②脱色过程中包括加入:(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→(填操作)。
③比色法确定待测液的浓度其原理是:_____________________________________________。
④若某补铁剂是由乳酸(![]() )与铁粉作用生成的,请写出该反应的化学方程式:____________________________________________。
)与铁粉作用生成的,请写出该反应的化学方程式:____________________________________________。
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是???????????? 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为????? ,表中y=???? 。
②T1?? ??? T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为??????? 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-) 之比为?????????? 。
②该溶液中c(OH-) = c(H+)+ ??????? + ??????? (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-)???? ,c(Na+)???? 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 ??????????? 。
A.Na2CO3?? ???? B.Ba(NO3)2 ??? C.Na2S??? D.酸性KMnO4
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com