
题目列表(包括答案和解析)
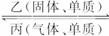
(1)乙在周期表中的位置____________。
写出一个A与甲可能的反应方程式:____________。
(2)请写出下列反应的离子方程式:G→H____________。
A、B、C、D、E、F、G、H、I、J 均为有机化合物。根据以下框图,回答问题:
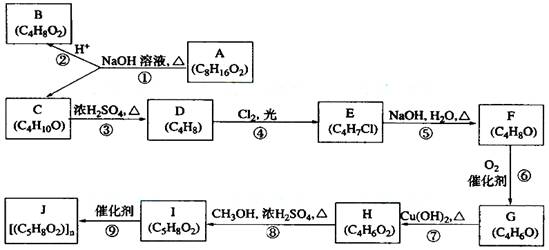
(1)B和C均为有支链的有机化合物,B的结构简式为_______________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为:_____________________;
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为___________________________________________;
(3)⑤的化学方程式是________________________________________________;
⑨的化学方程式是___________________________________________________;
(4)①的反应类型是________________,④的反应类型是________________, ⑦的反应类型是_____________________;
(5)与H具有相同官能团的H的同分异构体的结构简式为____________________
______________________________________________________________。
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
A、B、C、D、E、F、G、H、I、J 均为有机化合物,其转化关系如下图所示。已知B 和 C 均为有支链的有机化合物;C在反应③中只能生成一种有机产物;G能使溴的四氯化碳溶液褪色。回答问题:
(1)G的结构简式:____________________。⑦的反应类型____________________。
(2)步骤⑤的化学方程式 ______________________________________________。
(3)步骤④中的“Cl2、光”能否改为“Cl2的四氯化碳溶液”?请说明原因:__________
(4)写出与H 具有相同官能团的任一种同分异构体的结构简式_____________________
(5)在一定条件下,酯与醇会发生酯交换,生成新的酯和醇。请尝试书写I与F发生的酯交换反应方程式:_____________________________________________________。
(6)一定条件下,G和H发生1:1聚合,聚合产物有多种。写出其中任一种聚合产物的结构简式:____________________________________________________________。
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。
(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com