
题目列表(包括答案和解析)
(11分)根据所学知识,完成下列要求。
(1)0.2 mol OH-的质量为 ,其中含有 个电子;标况下 L HCl气体溶于水可配成12 mol/L HCl溶液500 mL。
(2)我国是最早使用铜及其合金的国家之一,我国古代劳动人民更最早利用天然铜的化合物进行湿法炼铜,这是湿法技术的起源,是世界化学史上的一项发明。西汉《淮南子·万毕术》记载:曾青得铁则化为铜,曾青为硫酸铜。
在该反应中被氧化的元素是 ,氧化剂是 ;该反应的离子方程式为: 。
(3)就有关物质的分离回答下面的问题。
①现有一瓶A和B的混合液,已知它们的性质如下表。
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
|
A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
|
B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是 。
②在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答: 。
(17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。

(3) 实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验

用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________ 。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。
(17分,每空1分,特别说明的除外)下表是元素周期表的一部分,回答下列有关问题: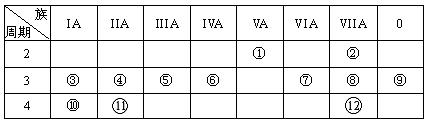
(1)写出下列元素符号:① ______,⑥ ______,⑦ __ __。
(2)画出原子的结构示意图:④___ __ ___,⑧___ 。
(3)在①~12元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是____。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常 温下⑦的单质和⑧的单质状态不同b.⑧的氢化物比⑦的氢化物稳定
温下⑦的单质和⑧的单质状态不同b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (填序号),跟它同周期 原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物,用电子式表示其形成过程如下: (2分)。
原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物,用电子式表示其形成过程如下: (2分)。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程: 
(17分,每空1分,特别说明的除外)下表是元素周期表的一部分,回答下列有关问题:
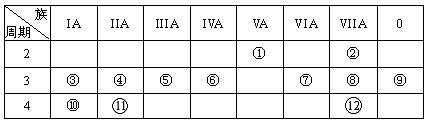
(1)写出下列元素符号:① ______,⑥ ______,⑦ __ __。
(2)画出原子的结构示意图:④___ __ ___,⑧___ 。
(3)在①~12元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是____。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (填序号),跟它同周期原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物,用电子式表示其形成过程如下: (2分)。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
第5页
请回答:
(1)浓硫酸的作用是 ;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式: 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束震荡静止后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”, 来确定副产物中存在乙醚。请你对该同学的观点进行评价: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com