
题目列表(包括答案和解析)
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。

据此得出的下列结论中错误的是
A. I-、Fe2+、I2的还原性和Cl2、Fe3+、I2的氧化性都依次减小
B.当n(Cl2)/n(FeI2)==1.2时,离子方程式为2Fe2++10I-+6Cl2==5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)==6.5时,溶液中n(Cl-)/n(IO3-)==6.5
D.若溶液体积不变,溶液的pH始终不变
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。
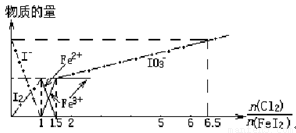
下列结论错误的是( )
A.Cl2、I2、IO3-、Fe3+的氧化性依次减小
B.当n(Cl2)/n(FeI2)=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-)/n(IO3-)=6.5
D.若溶液的体积不变,则溶液的pH减小
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。

下列结论错误的是( )
A.Cl2、I2、IO3-、Fe3+的氧化性依次减小
B.当n(Cl2)/n(FeI2)=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-)/n(IO3-)=6.5
D.若溶液的体积不变,则溶液的pH减小
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。
下列结论错误的是( )
A.Cl2、I2、IO3-、Fe3+的氧化性依次减小
B.当n(Cl2)/n(FeI2)=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-)/n(IO3-)=6.5
D.若溶液的体积不变,则溶液的pH减小
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。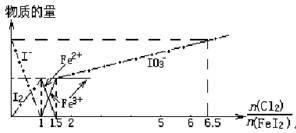
下列结论错误的是( )
| A.Cl2、I2、IO3-、Fe3+的氧化性依次减小 |
| B.当n(Cl2)/n(FeI2)=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl- |
| C.当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-)/n(IO3-)=6.5 |
| D.若溶液的体积不变,则溶液的pH减小 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com