
题目列表(包括答案和解析)
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。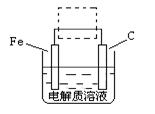
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移
mol电子。
6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移
mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。

②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O26SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
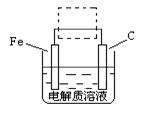
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
(12分)铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:
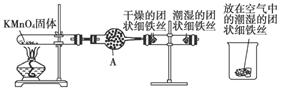
首先检查制取氧气装置的气密性,然后按上图所示连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形导管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形导管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于____________。
(2)仪器A的名称为____________,其中装的药品可以是________,其作用是________。
(3)由实验可知,该类铁生锈的条件为____________________________________ ____________________________________。
决定铁生锈快慢的一个重要因素是________。
(12分)铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:
首先检查制取氧气装置的气密性,然后按上图所示连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形导管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形导管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于____________。
(2)仪器A的名称为____________,其中装的药品可以是________,其作用是________。
(3)由实验可知,该类铁生锈的条件为____________________________________ ____________________________________。
决定铁生锈快慢的一个重要因素是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com